Les cellules souches embryonnaires forment un énorme potentiel de traitement et de guérison de nombreux problèmes médicaux. C’est la raison pour laquelle le prix Nobel a récompensé en 2012 la découverte que des cellules induites similaires aux cellules souches peuvent être élaborées à partir de cellules de la peau (cellules iPS). Malheureusement le processus est resté très lent et inefficace, et les cellules souches obtenues ne sont pas encore prêtes pour un usage médical. Une recherche effectuée dans le laboratoire du docteur Yaqub Hanna, à l'Institut Weizmann, publiée aujourd'hui dans la revue Nature, a provoqué un grand changement : les travaux menés avec son groupe ont révélé le « frein » ralentissant la production des cellules souches, et ont montré que le fait de libérer ce frein peut à la fois synchroniser le processus et augmenter son efficacité jusqu’à atteindre 100 %, alors qu’actuellement elle est d’environ 1 %. Ces résultats pourraient faciliter la production de cellules souches pour l’usage médical, et permettre de mieux comprendre le mystérieux processus qui fait que des cellules adultes peuvent faire marche arrière vers leur état embryonnaire original.
Les cellules souches embryonnaires sont des cellules qui n’ont subi aucune « spécialisation » et elles peuvent donc être à l’origine de n’importe quel type de cellule dans le corps. C’est ce qui les rend si précieuses : elles peuvent être utilisées, par exemple, pour reconstituer des tissus endommagés, pour traiter les maladies auto-immunes, et même pour développer des organes destinés à être greffés. L’utilisation de cellules souches ôtées aux embryons est problématique à cause de leur indisponibilité et à cause de problèmes éthiques, mais depuis 2006 il y a un nouvel espoir, car un groupe de recherche, sous la direction de Shinya Yamanaka, de l’université de Kyoto, a découvert qu’il est possible de « reprogrammer » des cellules adultes. Les cellules obtenues, appelées cellules souches pluripotentes induites (iPSC en anglais) sont fabriquées par l’insertion de quatre gènes dans leur ADN. Malgré ce grand pas en avant, le processus de reprogrammation est extrêmement difficile : il faut quelquefois compter jusqu’à quatre semaines, le timing n’est pas coordonné parmi les cellules, et en fait seulement moins d’un pour cent des cellules traitées deviennent des cellules souches.
Le docteur Hanna et son groupe ont posé la question suivante : quel est le principal obstacle – ou quels sont les principaux obstacles – qui empêchent la réussite de la reprogrammation de la majorité des cellules ? Dans sa recherche postdoctorale, le docteur Hanna a utilisé des modèles mathématiques pour montrer que la responsabilité incombe à un seul et unique obstacle. Le docteur Hanna admet, bien sûr, qu’en biologie il faut une preuve expérimentale pour valider les modèles. Non seulement la recherche actuelle en fournit la preuve, mais de plus elle révèle l’identité de cet unique obstacle et montre qu’en le supprimant, on peut augmenter la reprogrammation de manière extraordinaire.
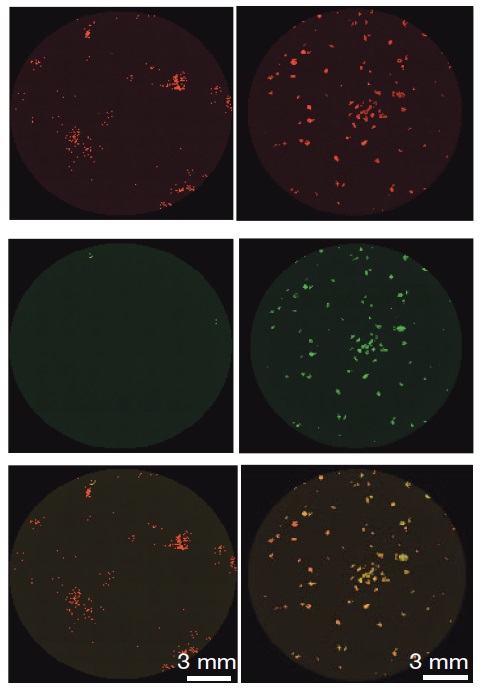
Le groupe du docteur Hanna, sous la direction de la docteur Noa Novershtern, avec Yoach Rais, Asaf Zviran, et Shay Geula, du département de Génétique moléculaire, avec des membres de l’unité de génomique du centre de Protéomique structurale d’Israël, situé à l'Institut Weizmann, a observé une protéine, MBD3, dont la raison d’être était inconnue. Cette protéine a attiré leur attention parce qu’elle est exprimée dans toutes les cellules du corps, à toutes les phases de leur développement. Ceci est assez rare : en général, la plupart des types de protéines sont produites dans des cellules spécifiques, à des moments spécifiques, dans des buts spécifiques. Le groupe a découvert qu’il y a une seule exception à la règle de l’expression universelle de cette protéine : ce sont les trois premiers jours après la conception. Ce sont exactement les trois jours au cours desquels l’œuf fécondé commence à se diviser, et l’embryon est une balle faite de cellules souches pluripotentes qui finiront par fournir tous les types de cellules dans le corps. Le quatrième jour, la différenciation débute et les cellules commencent déjà à perdre leur statut pluripotent. Et c’est juste à ce moment-là que les protéines MBD3 font leur apparition.
Cette découverte a d’importantes implications pour la production des iPSC pour l’usage médical. Le professeur Yamanaka utilise des virus pour insérer les quatre gènes, mais pour des raisons de sécurité, il ne les utilise pas pour reprogrammer les cellules qui doivent être utilisées par les malades. Ceci a pour conséquence que le pourcentage de réussite est encore plus bas, atteignant à peine 0.1 %. Les chercheurs ont montré que le fait de supprimer MBD3 dans les cellules adultes peut augmenter l’efficacité et accélérer de plusieurs ordres de grandeur le processus. Le temps nécessaire pour produire ces cellules souches a été raccourci de quatre semaines à huit jours. De plus, du fait que toutes les cellules ont subi la reprogrammation au même rythme, les scientifiques seront dorénavant capables, pour la première fois, de la suivre véritablement pas à pas et de découvrir les mécanismes de cette opération. Le docteur Hanna fait observer que le succès de son groupe est basé sur la recherche des voies naturelles du développement embryonnaire : « Les chercheurs qui travaillent sur la reprogrammation peuvent mieux comprendre comment les cellules souches embryonnaires sont produites dans la nature. Il ne faut pas oublier que c’est elle qui les fait au mieux et de la manière la plus efficace. »
La recherche du docteur Yaqub Hanna est financée par : Pascal et Ilana Mantoux, France/Israël; Leona M. and Harry B. Helmsley Charitable Trust; Sir Charles Clore Research Prize; Benoziyo Endowment Fund for the Advancement of Science; Erica A. Drake et Robert Drake; le European Research Council; et la Fritz Thyssen Stiftung.