¿Qué mantiene a las células de leucemia vivas casi siempre, y las vuelve capaces de seguir dividiéndose sin fin y de manera agresiva? Una nueva investigación del Instituto Weizmann sugiere que, en alrededor de una cuarta parte de todas las leucemias, las células cancerosas dependen de un "limite interno del terror" para poder sobrevivir. Cuando un gen determinado muta, se convierte en un gen promotor del cáncer - un oncogén. Pero los nuevos hallazgos muestran que la versión normal del gen, que funciona junto a la mutante, es la que mantiene a las células tanto cancerígenas como vivas, y les permite continuar su ruta destructiva en el cuerpo. Esta investigación fue publicada la semana pasada en Cell Reports.
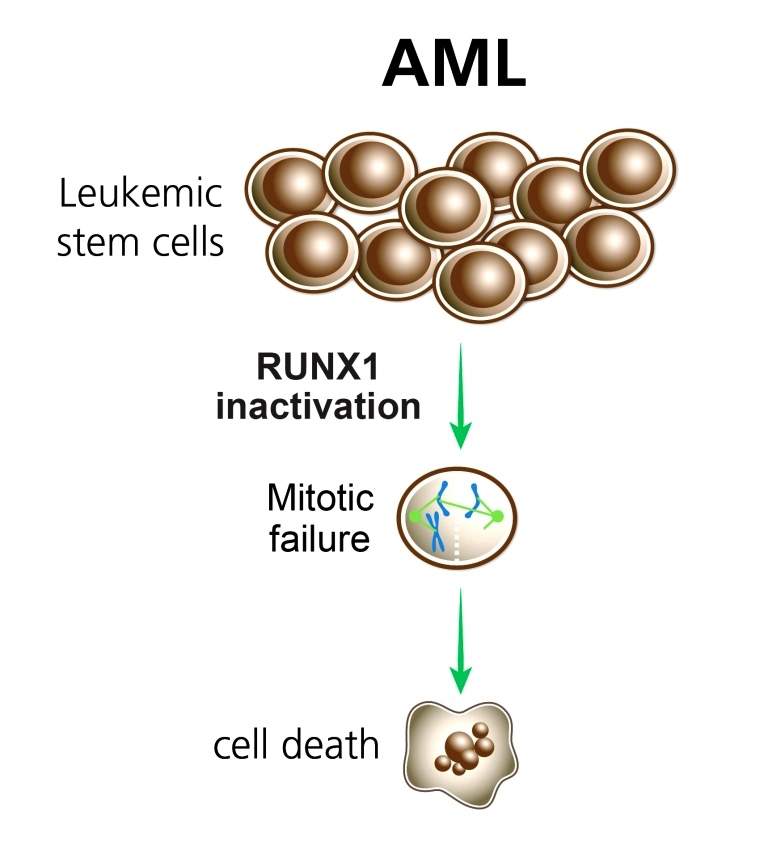
Este gen, el RUNX1, es crucial para el desarrollo y mantenimiento del sistema circulatorio de la sangre. El gen codifica un factor de transcripción - una proteína que regula la expresión de muchos otros genes. En el sistema sanguíneo, este factor de transcripción dirige la diferenciación de ciertas células madre adultas que se encuentran en la médula ósea y crean diversas células sanguíneas. Sólo se necesita una única mutación del gen RUNX1 en este tipo de células madre para que las células madre se vuelvan leucémicas. La leucemia mieloide aguda (AML, por sus siglas en inglés), por ejemplo, se caracteriza por un tipo muy específico de mutación llamada translocación. Un poco del material genético del cromosoma 8 alcanza el gen RUNX1 en el cromosoma 21 y se inserta en la secuencia genética. El resultado es un oncogén que codifica una proteína de fusión, la cual obtiene algunas nuevas funciones y pierde otras. Varias otras formas de leucemia, incluyendo la leucemia infantil más frecuente, la leucemia linfoide aguda (ALL por sus siglas en inglés), comienzan con una translocación similar que involucra al gen RUNX1 y al cromosoma 12.
"La oncoproteína de fusión, ya que regula directamente ciertos genes, conduce a una serie de otros cambios genéticos en la célula", dice el profesor Yoram Groner, del Departamento de Genética Molecular del Instituto, quien dirigió la investigación. Groner ha llevado a cabo una serie de estudios importantes del gen RUNX1 y otros 21 genes en cromosomas; entre ellos se incluye el desciframiento del papel del gen RUNX1 en la leucemia del síndrome de Down.
El presente estudio fue llevado a cabo principalmente por el becario postdoctoral, el Dr. Oren Ben- Ami, del laboratorio de Groner, junto con el grupo del Dr. Amos Tanay del Departamento de Ciencias de la Computación y Matemática Aplicada y Dra. Dena Leshkowitz del Centro Nacional de Medicina Personalizada de Israel. En preparación para su investigación, los científicos estaban buscando información en varias bases de datos biomoleculares. En este proceso se percataron de algo inusual: Los datos clínicos sugieren que la segunda copia del gen RUNX1 - la saludable, el gen no mutado – siempre es conservada en las células leucémicas y se encuentra en un estado de alta actividad. Por supuesto, casi todos los genes en nuestras células son dobles - una copia proviene de cada padre – y es probable que las mutaciones que conducen al cáncer se produzcan tan sólo en uno de los genes del par. Pero en algún momento de la evolución del cáncer, los genes sanos normalmente tienden a ser silenciados o dominados y los mutados terminan imponiéndose.
Esto sugirió al equipo de Groner una noción bastante poco ortodoxa: La versión sana del gen RUNX1 también puede jugar un papel en el desarrollo de la enfermedad. Pero, ¿cómo y en qué momento?
Para responder esta pregunta, los investigadores cultivaron células leucémicas en un plato de laboratorio, silenciando uno de las dos versiones del gen RUNX1, la sana o la mutante. Efectivamente, cuando el gen normal fue silenciado, las células murieron, mientras que las células con las dos versiones del gen, mutante y saludable, actuaron como células de cáncer muy potentes, negándose a morir. Investigaciones adicionales revelaron que las células de cáncer lograban evitar un tipo de muerte celular conocida como apoptosis - un mecanismo de suicidio que generalmente impide la multiplicación de células que albergan mutaciones potencialmente cancerígenas. En otras palabras, parece ser que es el gen sano, en lugar del mutante, el responsable de una de las características más peligrosas de las células del cáncer - su obstinada persistencia.
Groner dice que el estudio demuestra que las células leucémicas son "adictas" a la versión sana del gen RUNX1, es decir, que son fisiológicamente dependientes de la actividad de este. "A medida que continúa el proceso de mutación, el proceso de translocación del oncogén es muy eficiente en transformar la célula en una célula de cáncer. Cuando las cosas van demasiado lejos en la dirección de la destrucción total, la célula necesita limitar el terror para evitar su propia muerte".
Groner espera que estos resultados abran la puerta a nuevas opciones en la búsqueda de un mejor diagnóstico y tratamientos de estas formas de leucemia. Además, los resultados sugieren que la actividad de los genes sanos junto a sus homólogos mutantes puede desempeñar un papel importante en un número de otros procesos cancerígenos. "Es algo que nadie consideró antes", dice Groner.
Los proyectos de investigación del Prof. Yoram Groner son apoyados por el Instituto de la Familia Kekst de Medicina Genética que él dirige; el Instituto Dr. Moross de Investigación de Cáncer que él dirige; el Centro de la Familia de David y Fela Shapell de Desordenes Genéticos, que él dirige; y el Fondo Leona M. y Harry B. Helmsley. El Prof. Groner es el titular de la Cátedra Profesional Dr. Barnet Berris de Investigación del Cáncer.
Los proyectos de investigación del Dr. Amos Tanay son apoyados por Pascal e Ilana Mantoux, Israel/Francia; el Fondo de la Familia Wolfson; el Fondo Rachel y Shaul Peles de Investigación Hormonal; y el Fondo Evelyn Wellner. El Dr. Tanay es el titular de la Cátedra Profesional Vitalicia Robert Edward y Roselyn Rich Manson.