ד"ר מרים אייזנשטיין ופרופ' אפרים קציר ממכון ויצמן למדע זכו בתחרות בינלאומית לחיזוי ממוחשב של הדרך שבה חלבון-בולם נצמד ומנטרל את האנזים שבאמצעותו חיידקים גורמי מחלות מתחמקים מתרופות אנטיביוטיות דמויות פניצילין. החיזוי בוצע באמצעות "מתכון" ממוחשב שפותח בידי צוות חוקרים רב תחומי שפעל במכון ויצמן למדע, בראשותו של פרופ' אפריים קציר.
חיידקים שונים שפיתחו כושר עמידות כנגד תרופות אנטיביוטיות דמויות פניצילין, מפרישים את האנזים לקטמאז-ביתא, וכך הם מפרקים את החומרים התרופתיים שנועדו לפעול נגדם. דרך אחת לניטרול הנשק החיידקי הזה, מבוססת על חלבון-בולם שמיוצר בדרך הטבע על ידי חיידקים אחרים. החלבון הבולם נצמד לאנזים החיידקי ומדכא את פעילותו. הבנה טובה יותר של התהליך הזה עשויה לאפשר הכחדה יעילה של חיידקים גורמי מחלות שפיתחו עמידות כנגד תרופות אנטיביוטיות דמויות פניצילין.
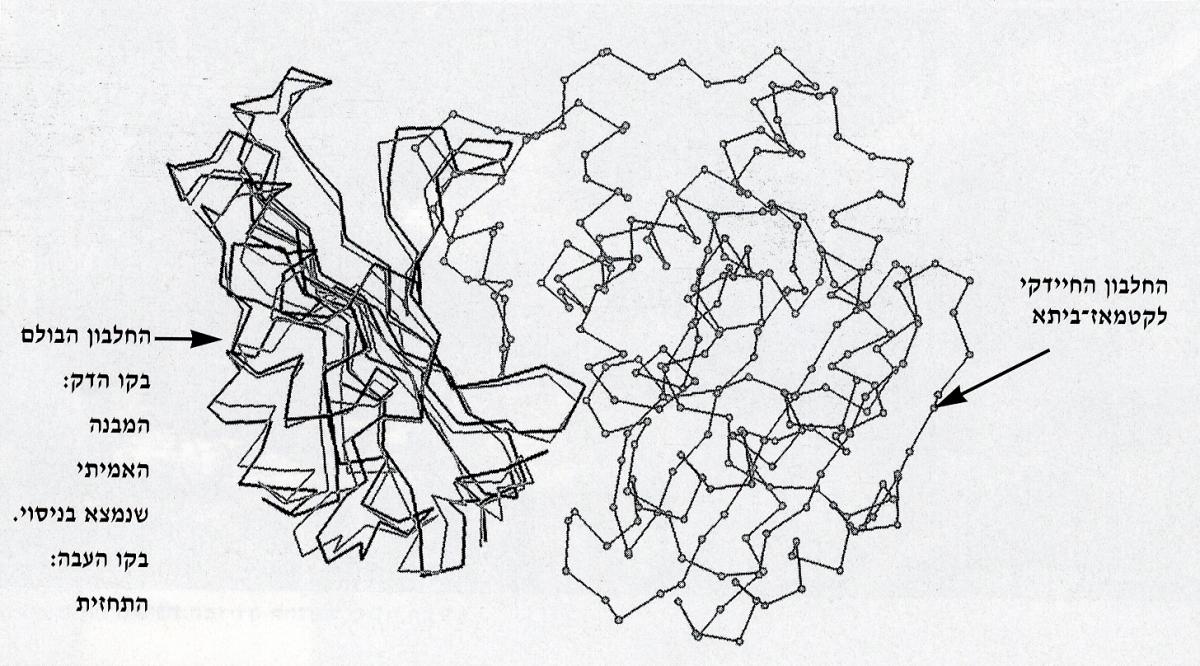
המדען הקנדי ד"ר מייקל ג'יימס, שביצע ניסוי שקירב אותו לגילוי הדרך המדוייקת שבה החלבון הבולם נצמד לאנזים החיידקי לקטמאז-ביתא, הציע אתגר לחוקרים רבים בעולם שמתמחים בחיזוי ממוחשב של מבנים משולבים של זוגות מולקולות. שש קבוצות מחקר שפועלות במקומות שונים בעולם נענו לאתגר והציעו 40 תחזיות שונות באשר לעיצובו של המבנה המשולב שכולל את החלבון הבולם ואת האנזים לקטמאז-ביתא.
ד"ר מרים אייזנשטיין ממכון ויצמן למדע ברחובות, הצליחה לענות על השאלה באמצעות יישומו של "מתכון" ממוחשב שפותח במכון ויצמן למדע על ידי צוות חוקרים רב-תחומי בראשותו של הפרופ' אפרים קציר. חברי הצוות היו ד"ר יצחק שריב, ד"ר מרים אייזנשטיין, פרופ' אשר פריזם, ד"ר קלוד אפללו, וד"ר איליה ואקסר. ה"מתכון" שניסח הצוות הישראלי הוא שורת פקודות מחשב שגורמת להזזה של מודלים ממוחשבים תלת-ממדיים של המולקולות הנחקרות, זו כנגד זו, עד שנמצא השילוב הטוב ביותר שמאפשר להן להיצמד זו לזו.
זמן לא רב לאחר שקבוצות המחקר שהשתתפו בתחרות הגישו את תחזיותיהם לד"ר ג'יימס, התגלה המבנה שבו החלבון הבולם והאנזים החיידקי לקטמאז-ביתא נצמדים זה לזה בפועל. התחזית שהגישה ד"ר מרים אייזנשטיין ממכון ויצמן למדע, נמצאה הקרובה ביותר למבנה המציאותי.
ה"מתכון" המנצח שפותח על ידי חוקרי מכון ויצמן למדע, נועד לבחון באמצעות מודלים ממוחשבים את יכולתן של מולקולות שונות לזהות מולקולות אחרות ולהיצמד אליהן. תהליך זה של הכרה ספציפית בין מולקולות, הוא אחד מהתהליכים הבסיסיים ביותר והחיוניים לפעילותם של כל הצמחים ובעלי החיים, לרבות האדם. הבנה טובה יותר של תהליך ה"הכרה" הבין-מולקולרי עשויה לאפשר את ביצוען של מניפולציות שונות בגורמי ההכרה וההיצמדות הבין-מולקולריים, כך שאפשר יהיה להאיץ או להאט (ואפילו לבלום) תהליכים שונים (כגון התהליך שבו החלבון הבולם נצמד אל האנזים החיידקי לקטמאז-ביתא ומנטרל אותו, דבר שחושף שוב את החיידק להשפעתן של התרופות האנטיביוטיות דמויות הפניצילין).
חלק מ"סוד ההכרה" בין מולקולות, נובע מהתאמה מבנית ביניהן - כמו ההתאמה שבין שני חלקים מתאימים של משחק "פאזל" (תצרף) תלת-ממדי, או כמו ההתאמה שבין מפתח למנעול. בנוסף להתאמה המבנית פועלים בין המולקולות כוחות פיסיקליים שונים המפעילים משיכה ודחייה. ה"מתכון" שפיתח הצוות הרב-תחומי שפעל בראשותו של הפרופ' אפרים קציר, השתמש בתכונת ההתאמה המבנית במטרה לחזות מראש האם וכיצד שתי מולקולות (שהמבנה שלהן עצמן ידוע) יכירו זו את זו וייצמדו זו לזו.
בימים אלה עוסק צוות החוקרים הרב תחומי במכון ויצמן למדע, בהרחבת ובפיתוח ה"מתכון" המנצח, כך שיכלול גם את השפעתם של מטענים חשמליים (אלקטרו-סטטיים) על תהליכי ההכרה וההיצמדות הבין-מולקולריים. שכלולים אלה של המתכון יאפשרו ליישם אותו בעתיד בתכנון תרופות חדשות.
בנוסף נבדקת האפשרות להשתמש במתכון למטרות נוספות, דוגמת בניית מודלים של סיבים ביו-מולקולריים.
המחקר נתמך על ידי קרן רש"י.